생물학적 전자 현미경; 생물학 연구의 새로운 발견을 위한 더욱 중요한 데이터 찾기

인터뷰 08
롤랜드 플렉
영국 런던 킹스칼리지 교수
세포 및 분자 구조를 이해하는 것은 생물 의학 연구의 주요 기초입니다. King's College London의 CUI(Centre for Ultrastructural Imaging) 소장인 Roland Fleck 교수는 JEOL 전자 현미경을 사용하여 구조물의 고해상도 이미징에 전념하고 있습니다. 그는 JEOL과 협력하여 JSM-7800FPRIME, JEM-F200 및 기타 JEOL 기기와 같은 주사 및 투과 전자 현미경을 모두 사용합니다. JEOL 첨단 기술 센터(JCAT)인 센터는 실온 및 극저온 전자 현미경 기술을 전문으로 합니다.
복잡한 생물학적 과정을 이해하는 것이 중요한 이유.
Fleck 교수가 이끄는 King's College London의 CUI(Centre for Ultrastructural Imaging)는 복잡한 생물학적 과정을 이해하기 위해 투과 전자 현미경(TEM)과 주사 전자 현미경(SEM)을 모두 사용하는 고급 이미징 기술의 적용에 중점을 둡니다. "생물학적 과정"은 게놈 구성, 신호 변환, 세포 주기 진행 및 기타 복잡한 시스템을 포함하는 다양한 종류의 생물학적 현상을 다룹니다.
인간의 몸에는 눈이 보고, 다리가 걷는 등 다양한 기능에 특화된 여러 영역이 있습니다. 기능의 공간적 전문화는 모든 규모에서 발생합니다. 눈 내에서 수정체와 광수용기 세포는 시각에 다르게 기여하고, 각 광수용기 세포의 다른 부분에 클러스터된 서로 다른 분자는 서로 다른 작업을 수행합니다(일부는 빛을 감지하고 다른 일부는 뇌에 빛이 감지되었음을 알립니다. ). 그러나 배율의 분자 수준은 약 1,000,000x입니다. 이것은 일반 광학현미경으로는 달성할 수 없으며 더 짧은 파장의 전자를 사용하는 현미경이 필요합니다. 그러나 전자현미경은 일반적으로 머리카락 굵기의 1분의 1000에 해당하는 매우 얇은 조직 샘플을 보는 것으로 제한되며, 하나의 세포를 모두 포함하려면 수백 개의 얇은 부분이 필요합니다.
전자현미경 연구를 위해 먼저 세포와 조직을 준비해야 합니다. 이 준비를 수행하는 방법에는 표본 준비 절차를 이해하고 최적화하기 위한 다양한 분야의 전문 지식과 연구가 필요합니다. Fleck 교수는 샘플에서 더 높은 품질의 정보를 얻기 위해 연구를 통해 샘플 준비를 개선하려고 합니다. Fleck 교수는 "이러한 맥락에서 JEOL과의 협업이 매우 중요합니다."라고 말합니다.
생물학적 조직의 냉동 준비.
생물학적 조직은 세포 그룹으로 구성됩니다. 예를 들어, 심장은 다양한 조직(심근, 혈관, 신경 등)으로 구성되어 있으며 이러한 조직이 일정한 순서로 결합되어 생물학적 역할을 하는 기관입니다. 따라서 조직의 형태와 구조를 이해하는 것이 필수적입니다.
극저온 전자현미경은 "원시" 상태를 보존하기 위해 저온을 사용하여 이러한 조직 샘플을 관찰할 수 있습니다. 샘플은 냉각되고 전자 현미경에 장착된 "저온" 단계에서 매우 낮은 온도로 유지됩니다. 동결(유리화) 시 결정 얼음을 피하는 것은 극저온 전자 현미경의 분해 가능성을 여는 기본입니다. 유리화는 구조를 원래 상태로 볼 수 있게 하여 일반적으로 화학적 고정 및 탈수 준비 기술과 관련된 인공물뿐만 아니라 세포 내 얼음 형성으로 인한 미세구조 파괴를 방지합니다.
Fleck 교수는 동결 시 얼음 결정을 피하는 문제를 해결하는 여러 저온 기술을 사용합니다. 급속 냉각은 중간 극저온유체(예: 에탄 또는 프로판)를 사용하여 소량의 유리화를 허용합니다. 이것은 라이덴프로스트 효과(한류제를 끓는점 이상으로 올려서 생성된 절연 증기막이 냉각 속도를 늦추는 현상)를 방지합니다. 이것은 자크 뒤보셰(Jacques Dubochet, 2017년 노벨 화학상)가 단일 입자 TEM에 대한 TEM 그리드에서 필름으로 작은 분리 입자를 유리화하기 위해 확립한 접근 방식입니다. 전체 세포 또는 조직의 두꺼운 샘플에는 고압 냉동기가 사용됩니다. 고압 동결(HPF) 기술은 물의 물리학을 기반으로 합니다. 동결 중에 가해지는 2100바의 압력은 물리적 동결 방지제 역할을 합니다. 고압은 결정화 시 물의 팽창을 상쇄하여 얼음 결정 형성을 늦추고 유리화(10,000°C)에 필요한 임계 냉각 속도를 감소시킵니다.-1).
유리화된 조직 블록은 동결 대체에 의해 처리될 수 있으며, 극저온 온도(CEMOVIS)에서 단면화되거나 동결 SEM에서 골절되고 직접 관찰되거나 TEM에서 본 복제본의 생성에 따라 처리될 수 있습니다. Fleck 교수는 이러한 각각의 기술을 사용하여 다양한 질문에 답합니다. 예를 들어 HPF는 이제 전기 자극 및 빛 자극과 통합되어 정보가 뇌의 한 뉴런에서 다른 뉴런으로 전달되는 방식을 연구하는 데 적용될 때 자극과 고정 사이의 높은 수준의 시간적 상관 관계를 허용합니다.
광학현미경에서 형광 태그는 살아있는 세포의 구획에 국한된 단백질을 표시하는 데 사용되지만 기본 미세구조를 엿볼 수는 없습니다. 전자 현미경은 세포 미세 구조를 표시할 수 있는 해상도를 가지고 있지만 형광 태그를 "볼" 수 없습니다. 대신 면역 골드 라벨링은 항체가 항원 세포 및/또는 조직에 특이적으로 결합하는 항원-항체 반응을 활용하여 전자 현미경으로 표적(특정) 세포 및/또는 조직의 위치(국소화)를 시각화(태그)하는 데 사용됩니다. 이 기술의 경우 냉동 초박형 절편 방법(Tokuyasu 기술)은 먼저 샘플을 액체 질소(~ <100°Cs-1). 조직은 다음 cryo ultramicrotomy에 의해 단면화되고 immunogold로 표시됩니다.
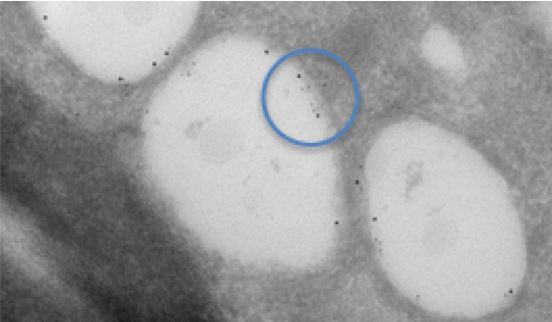
그림 1. C형 간염 바이러스에 감염된 세포에서 지질 방울의 이중 표지. 두 가지 다른 크기의 콜로이드 금을 사용하여 관심 있는 다른 단백질에 라벨을 지정하고 지질 방울의 내막에 각각 국한되어 있음을 보여줍니다. 조직은 Tokuyasu 기술을 사용하여 준비, 절단 및 라벨링되었습니다. 이중 라벨링은 파란색 원으로 강조 표시됩니다.
기생충학에 대한 SEM 및 TEM에 의한 세포 및 분자 구조 이해의 중요성.
말라리아의 세포 및 분자 구조를 이해하는 것은 효과적인 말라리아 치료제를 개발하는 데 필수적입니다. 말라리아, Plasmodium falciparum, 기생충은 적혈구(적혈구) 내에서 발생하며 막으로 둘러싸인 기생 액포 내부에 들어 있습니다. 발달하는 동안 기생충은 적혈구 표면을 수정하여 감염된 세포의 세포골격을 경직시키고 세포에 부착된 세포에서 경험하는 전단력을 세포골격으로 전달합니다. 완전히 개발되면 출구라고 하는 다단계 프로세스가 발생합니다. 이를 위해 기생충은 고도로 조절된 막 투과화 및 파괴 단계의 순서를 조정하여 새로운 감염 라운드에 대한 기생충의 폭발적인 방출로 절정에 달합니다.
이러한 과정을 이해하는 것은 말라리아의 수명 주기를 여는 열쇠입니다. 이 연구에는 전자 단층 촬영이 유용합니다. 전자 단층 촬영은 시료의 연속적인 틸트 시리즈 영상에서 획득한 많은 투영 영상을 컴퓨터 영상 처리를 통해 시료의 3차원 내부 구조를 재구성하는 방법입니다. Fleck 교수는 고압 동결, 동결 치환 감염된 적혈구의 전자 단층 촬영 및 유리화된 적혈구 유령의 저온 전자 단층 촬영을 사용하여 적혈구 표면의 XNUMX차원 변형을 조사합니다. 전자 밀도 층으로 코팅된 나선형 구조로 구성된 고도로 조직화된 노브 골격이 노브 멤브레인 아래에 있습니다. 이 손잡이 골격은 적혈구 세포 골격에 여러 링크로 연결되어 있습니다. 그런 다음 노브의 막 단백질 배열을 고해상도 동결 골절 SEM으로 시각화했습니다. 샘플은 살아있는 기생충의 고압 동결 및 동결 골절에 의해 준비되었습니다. 막 구조는 고해상도로 나타났고 노브 구조는 주변 적혈구막과 구별되었으며 정점에 있는 구조는 접착 부위를 나타낼 가능성이 있습니다. 따라서, P. falciparum 감염의 적혈구 손잡이는 막의 특수 영역 아래에 있는 고도로 조직화된 골격 구조를 포함하는 것으로 나타났습니다.
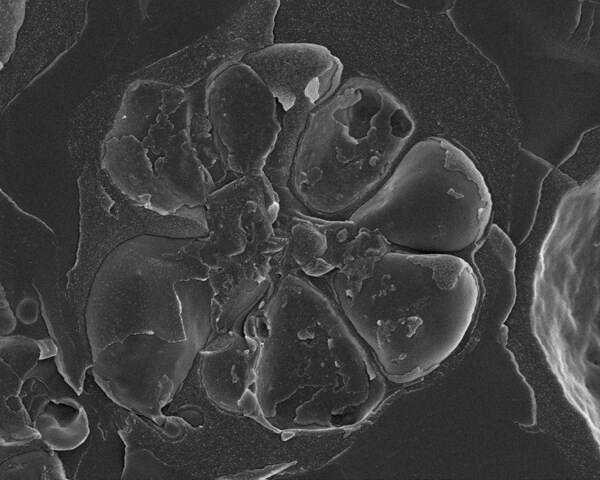
그림 2. 말라리아, Plasmodium falciparum, 적혈구(적혈구) 내에서 발생하는 기생충. XNUMX개의 merozoites는 막으로 둘러싸인 기생 액포 내에 포함되어 있습니다. merozoites는 중앙 잔류물 주위에 위치합니다. 골절 과정으로 인해 많은 개별 멤브레인이 드러납니다.
직렬 블록 면 SEM을 사용한 3D 재구성
뇌를 연구하는 것은 뇌의 신경 세포 연결을 밝히는 것이 학습과 기억의 메커니즘에 대한 이해로 이어지기 때문에 매우 중요합니다. 뇌의 모든 신경 세포 사이의 모든 연결을 밝히는 것을 목표로 하는 커넥톰 분석이 목적입니다. 이러한 연결을 시각화하기 위해 TEM은 뉴런 간의 연결을 관찰할 수 있지만 관찰 가능한 영역은 매우 얇고 제한적입니다. 따라서 이 경우 SBF-SEM(Serial Block Face SEM)이 매우 효과적이라고 Fleck 교수는 지적합니다.
SBF-SEM(Serial Block Face SEM)은 SEM을 이용하여 시편 블록의 3차원(3D) 구조를 재구성하는 방법입니다. 이 방법은 주로 수지가 삽입된 신경 "뇌" 조직과 같은 연질 재료의 30D 재구성에 사용됩니다. 뇌 조직의 블록 표본을 SEM 표본 챔버에 통합된 울트라마이크로톰으로 표면에서 ~500 nm의 두께로 >3 μm의 부피로 슬라이스한 다음 슬라이스에 의해 노출된 각 면을 관찰합니다. 수집된 이미지를 누적하여 표본 블록의 XNUMXD 구조를 얻습니다.
SBF-SEM 동안 샘플을 충전하면 조직 블록의 전도도를 개선하기 위해 생성되는 데이터의 품질이 제한될 수 있으므로 OTO 기술이 사용됩니다(osmium tetroxide-thiocarbohydrazide-osmium tetroxide). 이 프로토콜은 SBF-SEM보다 오래 전부터 지질의 대비를 향상시킵니다. Fleck 교수는 SBF-SEM을 사용하고 SBF-SEM에서 강력한 후방 산란 신호와 높은 전도성을 제공하기 위해 큰 침전물의 위험 없이 조직 블록 전체에 균일한 염색을 생성하기 위해 이러한 이전 처리 기술을 조정하고 수정합니다. Fleck 교수는 이 기술을 사용하여 CA1의 시냅스전 말단 구조 분포를 매핑했습니다. 지층 오리엔스, 정렬된 축삭 입력을 받는 해마 영역. 여러 영역의 데이터 스택을 재구성하고 조직의 참조 마커를 사용하여 공동 작업자가 결정한 시냅스 입력과 상관 관계가 있는 데이터를 사용했습니다. 수지상 분절은 흥분성 입력의 크기에서 넓은 분포를 나타내었지만, 시냅스 전 구획과 시냅스 후 구획의 형태학적 측정 사이에는 강한 상관 관계가 있었습니다. CA1 피라미드 뉴런의 기저 수상돌기에 형성되는 시냅스 전 부톤은 체세포로부터의 거리에 따라 활성 영역(AZ) 크기의 감소를 나타냅니다. 이것은 단기 촉진(기능)의 거리 의존적 증가를 제공합니다. 따라서, 형태에 의해 변조된 단기 촉진의 공간적 분포는 반복된 자극 동안 역치 이하 원위 입력의 electrotonic 감쇠를 보상하고 수지상 도메인의 기본 입력 주파수를 미세 조정하는 역할을 합니다.
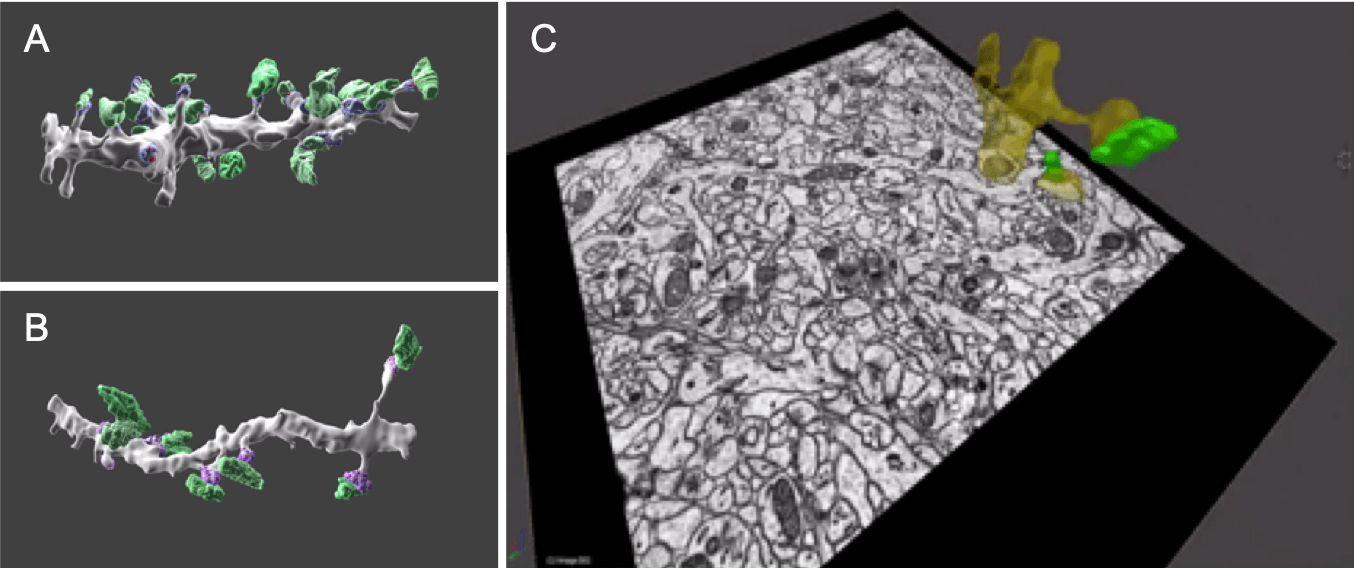
그림 3. 3D-View: 많은 뉴런을 포함하는 해마의 직렬 블록면 주사 전자 현미경. 플레이트 A와 B는 녹색으로 착색된 시냅스 전 부톤과 보라색 시냅스 밀도를 보여줍니다. A는 수상돌기의 근위부에서, B는 원위부에서 가져옵니다. 플레이트 C는 재구성된 수지상 구획(노란색)과 시냅스 전 부통(녹색)이 이미지에 겹쳐진 직렬 블록 면의 단일 슬라이스를 보여줍니다. 많은 개별 슬라이스를 수집하여 조직을 3D로 재구성할 수 있습니다.
광학현미경과 전자현미경을 결합하기 위한 CLEM(상관광전자현미경)
이 방법(CLEM)은 광학 현미경과 전자 현미경의 고유한 기능 조합을 사용합니다. 단백질이나 조직을 형광염색(labelling)하는 형광현미경을 이용하여 XNUMX차적으로 단백질이나 조직을 동정한 후 높은 공간해상도의 전자현미경을 이용하여 동정된 표적 부위의 형태나 구조를 관찰하는 데 사용됩니다. CLEM은 표지된 단백질 또는 조직의 기능 및 미세 형태(구조) 분석을 수행할 수 있는 생명 과학에서 널리 사용됩니다. CLEM은 TEM 또는 SEM 전자 현미경과 결합할 수 있으며 전문 극저온 스테이지를 추가하여 형광 및 고해상도 극저온 EM 기기 간의 상관 관계를 지원할 수 있습니다. CUI에는 따라야 할 여러 CLEM 작업 흐름이 있습니다. 여기에는 라이브 셀 이미징을 지원하는 특수 조직 배양 접시에서 세포를 성장시키는 Nikon to JEOL SEM 실온 워크플로가 포함됩니다. 이러한 조직 배양 접시는 실온 시료 처리 후 SEM에서 세포 처리와 이미징 사이의 상관 관계를 가능하게 합니다.
생명과학 발전을 위한 JEOL 첨단기술센터
극저온 전자 현미경과 구조 생물학 접근 방식을 결합하여 유리화된 세포 및 조직의 섹션에서 "현장" 3D 세포 구조를 결정하는 것은 세포 생물학의 새로운 개척지입니다. 그것은 cryo TEM뿐만 아니라 cryo 고정 및 cryo sectioning 도구가 필요합니다. 여기에는 JEOL JIB-4700F의 최신 집속 이온 빔 SEM(FIB-SEM)을 최적화하여 FIB 유리체 라멜라 준비 및 저온 TEM으로의 오염 없는 전송을 활용하는 것이 포함됩니다.
Fleck 교수는 “생물학적 전자현미경은 지난 XNUMX년 동안 눈부신 발전을 이루었습니다. 이제 우리는 JEOL과의 긴밀한 협업을 통해 새로운 도전을 모색할 것입니다. 우리는 최첨단 기기 개발을 위한 많은 아이디어와 제안을 교환할 수 있습니다. 이러한 미래 혁신에 참여하게 되어 매우 기쁩니다.”
JEOL Center for Advanced Technology(JCAT)는 또한 사회에 기여하는 중요한 역할을 합니다. JCAT는 신장질환, 피부질환 등의 진단을 위해 현지 병원에 다양한 기술을 제공하고 있습니다. JEOL JEM-1400Plus에 장착된 JEOL RUBY 카메라는 손쉬운 조작으로 조직검사에 매우 효과적입니다.
Flecks 교수는 “JEOL과의 파트너십을 기반으로 설립된 JCAT는 건설적인 협력 관계를 통해 새로운 도구와 기술의 아이디어가 탄생하고 생명과학 연구의 한 단계 더 발전하는 중요한 플랫폼이 될 것”이라고 강조했다.

롤랜드 플렉
영국 런던 킹스칼리지 교수
Fleck 교수는 스코틀랜드 에딘버러에 있는 Heriot Watt University에서 응용 해양 생물학을 공부한 후 담수 생물학 연구소로 옮겨 "저온 보존 민물 원생생물의 세포 손상 및 회복 메커니즘"에서 박사 학위를 취득했습니다. 그가 처음으로 전자현미경인 JEOL JEM-100CX를 다루기 시작한 것은 박사과정 중이었습니다. 박사 학위 후 그는 식물의 저온 순응을 연구하기 위해 코넬 대학으로 옮겼습니다. Cornell 대학에서 근무하는 동안 그는 Freeze Fracture/Freeze Etch 복제 기술로 광범위하게 작업했습니다. 그는 영국으로 돌아와 국립 생물 표준 및 통제 연구소(National Institute for Biological Standards and Control)에 합류하여 기능적 세포 기반 분석을 개발 및 표준화하고 전자 현미경 및 저온 영상 시설을 주도 및 개발했습니다. 그는 NIBSC를 떠나 King's College London의 Ultrastructural Imaging Center 소장의 역할을 맡았습니다.
게시일:2019년 XNUMX월
