생체 재료용 전자 현미경의 3D 이미징 방법 비교
절뉴스 Vol.53 No.8
하루타 토모히로
JEOL(주) 애플리케이션 관리부
TEM 단층 촬영은 미세 구조의 3차원(3D) 분석에 널리 사용되었습니다. 최근에는 SEM, FIB-SEM, SBF-SEM(Serial Block-Face SEM), 어레이 단층촬영을 이용한 새로운 3차원 구조 분석 방법이 컴퓨터와 SEM의 성능 향상으로 인해 많은 연구자들이 주목하고 있다. 이러한 방법은 TEM 단층 촬영에 비해 관찰 가능한 영역이 매우 넓기 때문에 생물학적 시료에 적합합니다. 각각의 방법에는 장단점이 있지만 동일한 샘플을 사용하여 이러한 방법을 비교한 예는 거의 없습니다. 이 연구에서는 동일한 샘플의 XNUMXD 구조를 재구성했습니다(E.coli 및 파지) FIB-SEM, SBF-SEM 방법, 어레이 단층 촬영 및 TEM 단층 촬영을 통해 이러한 방법의 장단점을 조사했습니다.
개요
세포와 조직의 기능을 이해하기 위해서는 세포를 구성하는 세포소기관과 단백질 복합체의 3차원 구조와 위치를 아는 것이 중요합니다. 이 정보는 학술 연구뿐만 아니라 치명적인 질병에 대한 치료법 개발에도 중요한 역할을 합니다. 이전에는 이러한 나노 구조의 3D 구조 관찰에 TEM 단층 촬영이 사용되었습니다. TEM 단층 촬영에서는 직렬 틸팅 이미지의 현미경 사진을 촬영하고 얻은 이미지 시리즈를 역투영하여 3D 이미지를 재구성합니다. TEM 단층촬영은 고해상도의 3차원 영상을 제공하며 전자빔의 투과에 의해 정의되는 두께 제한이 있습니다. 따라서 TEM 단층촬영으로는 전체 세포 또는 조직의 3차원 영상을 관찰하기 어렵다. 최근의 조직학이나 세포생물학은 분자생물학과 밀접한 관련이 있어 나노구조의 형태와 분포가 조직과 세포 전체에 미치는 영향을 밝히는 것이 중요하다. 이러한 이유로 세포 또는 조직 전체가 인식되는 넓은 영역을 관찰할 수 있고 세포소기관과 단백질 복합체를 인식하면서 고해상도를 유지할 수 있는 새로운 현미경 방법이 개발되었습니다. 본 연구에서는 FIB-SEM, SBF-SEM, 어레이 단층촬영의 3가지 새로운 1차원 관찰 방법에 초점을 맞추었다[2, 3, 1](그림 XNUMX).
그림 1 3D 재구성 방법의 개략도.
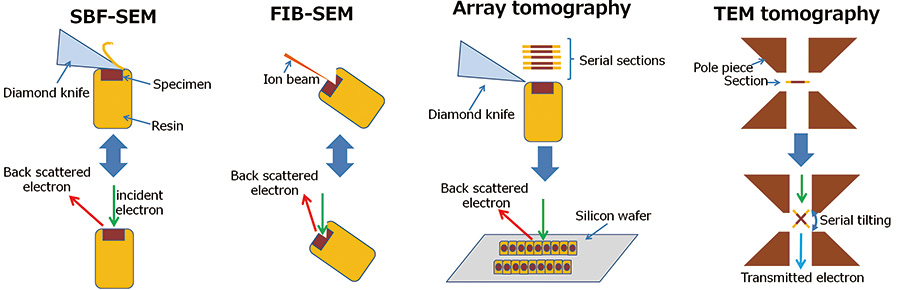
- SBF-SEM:
SBF-SEM은 다이아몬드 나이프로 샘플을 절단하고 시편 챔버에서 새로운 샘플 표면의 후방 산란 전자 이미지를 관찰하는 것을 반복합니다. - FIB-SEM:
FIB-SEM은 집속된 갈륨 이온빔에 의한 시료 스퍼터링과 시료 챔버에서 새로운 시료 표면의 후방 산란 전자 이미지의 관찰을 반복합니다. - 어레이 단층 촬영:
직렬 섹션은 울트라마이크로톰으로 준비되고 실리콘 웨이퍼와 같은 단단한 기판에 장착됩니다. 이러한 직렬 섹션은 후방 산란 전자 이미지를 위해 하나씩 취해져서 순서대로 쌓입니다. - TEM 단층촬영:
TEM 단층 촬영은 TEM에 의한 직렬 틸팅 투영 이미지를 취하고 이러한 이미지의 역 투영에 의해 내부 3D 구조를 재구성합니다.
FIB-SEM은 FIB(집속 이온빔) 컬럼이 장착된 SEM입니다. 시료 챔버의 시료는 FIB로 스퍼터링되며, 스퍼터링된 표면은 SEM으로 관찰할 수 있습니다. FIB는 생물학에서 인기가 없지만 재료 과학에서 인기가 있습니다. 재료과학의 표본(금속, 세라믹 등)은 너무 단단해서 다이아몬드 칼로 자르기 힘들지만 FIB로 스퍼터링하면 얇은 단면으로 만들거나 새로운 표면을 노출시킬 수 있기 때문이다. FIB-SEM으로 3차원 구조를 관찰하기 위해 시편의 표면을 스퍼터링하고 SEM으로 후방산란전자영상으로 새로운 노출면을 관찰하고 스퍼터링과 관찰의 과정을 반복한다. 마지막으로 직렬 단면 시리즈의 이미지를 쌓아서 3차원 구조를 재구성할 수 있습니다[1]. FIB-SEM의 장점은 스퍼터링 부위의 고정밀 측정과 뼈 및 금속과 같은 단단한 샘플의 얇은 부분 준비입니다. 반면에 관찰 영역이 좁고 스퍼터링 속도가 느린 단점이 있습니다.
SBF-SEM에서는 시편 챔버에서 다이아몬드 칼로 샘플을 절단하는 메커니즘이 있는 SEM을 사용합니다. 3D 이미지를 재구성하기 위해 샘플 챔버에서 다이아몬드 나이프로 샘플 표면을 슬라이스하고 SEM으로 새로운 노출 표면을 관찰합니다. 3차원 영상은 FIB-SEM[2]과 같은 연속 단면 시리즈의 영상을 쌓아 재구성한다. SBF-SEM의 장점은 다이아몬드 나이프로 샘플을 절단하기 때문에 높은 절단 속도와 넓은 절단 영역입니다. 한편, SBF-SEM은 높은 전자전도도와 강한 중금속 염색이 요구되는 시료를 준비해야 하기 때문에 특별한 시료 전처리(ex. NCMIR 방법)가 필요한 단점이 있다[3]. 이 특별한 샘플 준비에 의한 나노 구조의 보존 품질은 TEM에 대한 기존 준비보다 좋지 않습니다. 샘플의 전도도는 특별한 샘플 준비로 증가하지만 때때로 샘플이 대전될 수 있습니다.
Array tomography에서는 먼저 초박형 리본 시편을 ultramicrotome으로 준비하고 직렬 섹션을 실리콘 웨이퍼와 같이 전도성 웨이퍼에 장착합니다. 이러한 일련의 단면을 SEM으로 하나씩 관찰하고 3D 이미지를 재구성하여 이미지를 순서대로 쌓습니다[4]. 이 방법의 장점은 다음과 같습니다. 매우 얇고 전도성 웨이퍼에 실장되는 시료의 대전 억제, 기존의 SEM과 울트라마이크로톰만 있으면 되기 때문에 초기 비용이 저렴하고, 기존의 TEM 전처리 기술로 준비된 좋은 시료를 사용할 수 있습니다. 이 방법의 단점은 연속적인 섹션 시리즈를 준비하는 것과 같이 많은 수작업이 필요하다는 것입니다.
이러한 3차원 재구성 방법과 SEM의 원리는 거의 동일하기 때문에 이 세 가지 방법의 기능 및 사양을 비교하기 위한 논의는 거의 없습니다. 즉, 세 가지 방법을 통해 연속 섹션을 만들고 새로운 섹션을 관찰할 수 있습니다. 본 연구에서는 이러한 방법으로 동일한 시료의 3차원 구조를 관찰하고 그 결과를 비교하였다. 마지막으로 이러한 방법의 특징과 어떤 샘플 및 분석이 적합한지 논의하고 요약합니다. 또한 적절한 방법을 사용하여 일부 샘플의 분석을 시도했습니다.
재료 및 방법
우리는 사용 E.coli 샘플로 T4 파지, λ 파지, φ174 파지에 감염시켰다. 파지는 박테리아를 감염시키는 바이러스의 일종입니다. 크기는 200 nm 이하이며 전자현미경을 사용하지 않고는 형태를 관찰할 수 없다(Fig. 2 ac).
파지는 DNA 또는 RNA와 같은 게놈을 세포에 주입합니다. E.coli 파지가 붙을 때 E.coli. 감염된 파지는 숙주세포의 전사계, 번역계, 복제계를 인수하여 숙주세포 내에서 증식한다. 이 단계에서 우리는 에서 증식하는 파지를 관찰할 수 있습니다. E.coli (그림 2 df). 파지가 숙주에서 충분히 증식하면 파지가 파열되어 숙주 세포에서 나옵니다. 새로 증식된 파지가 새로운 숙주 세포에 부착되어 감염됩니다.
먼저 연질 LB 한천을 E.coli 단단한 LB 한천에. 파지가 감염되었다 E.coli 파지 함유 용액을 이 한천에 떨어뜨림으로써. 파지가 감염된 부위를 알 수 있었다. E.coli , 이 한천의 배양 후 플라크로 감염되고 파지를 얻었다. E.coli 이 플라크를 제거함으로써.
TEM 단층촬영 및 어레이 단층촬영의 경우, 샘플은 2.5M 소듐 카코딜레이트(pH 0.1)에 7.2% 글루타르알데히드로 접두사를 붙이고 1% OsO로 접미사를 붙였습니다.4 0.1 M 나트륨 카코딜레이트(pH 7.2). 고정 샘플은 에폭시 수지에 내장되었습니다. 샘플은 어레이 단층 촬영을 위해 실리콘 웨이퍼에 장착된 얇은 섹션으로 울트라마이크로톰에 의해 슬라이스되었습니다. 이 얇은 부분은 아세트산우라늄과 시트르산납으로 염색되었습니다.
FIB-SEM 및 SBF-SEM의 경우 강한 중금속 얼룩에 대해 NCMIR 방법을 적용했습니다[3]. FIB-SEM에서도 기존의 방법으로 준비된 샘플을 사용할 수 있으며, 본 연구에서는 NCMIR 방법을 적용하여 강한 콘트라스트 영상을 얻었다. 고정 및 염색 후 샘플을 에폭시 수지에 매립했습니다. 관찰 조건을 표 1에 나타내었다.
FIB-SEM, SBF-SEM 및 Array 단층 촬영으로 얻은 연속 단면 이미지는 Fiji [5]에 의해 정렬되었고 3D 이미지는 스태커(System In Frontier Inc. Japan)로 재구성되었습니다. TEM 단층 촬영에서 TEMography는 직렬 틸팅 이미지 및 3D 재구성의 획득에 사용되었습니다. 획득한 3D 이미지는 Colorist(System In Frontier Inc. Japan)에 의해 분할 및 분석되었습니다.
Fig.2 파지의 TEM 이미지.
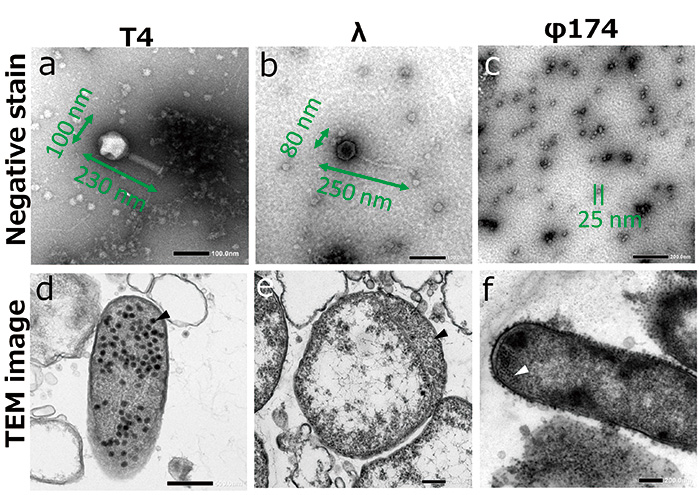
파지(ac) 및 증식의 음성 염색 이미지 E.coli (df, 화살촉).
표 1 3차원 관찰 방법의 관찰 조건.
| SBF-SEM | FIB-SEM | 어레이 단층 촬영 | TEM 단층 촬영 | |
|---|---|---|---|---|
| 악기 | Gatan 7800View 3XP가 포함된 JSM-2F | JIB-4610F | JSM-7800F | JEM-1400플러스 |
| 획득 영역(X,Y) | 24 × 24μm2 | 18 × 24μm2 | 19 × 24μm2 | 3.5 × 3.5μm2 |
| 획득 깊이(Z) | 7.5μm(50nm × 150 이미지) | 10.8μm(20nm × 543 이미지) | 1.4μm(70nm × 20 이미지) | 200 nm의 |
| 픽셀 크기(X,Y) | 3 nm의 | 9.4 nm의 | 4.7 nm의 | 1.72 nm의 |
| 픽셀 크기(Z) | 50 nm의 | 20 nm의 | 70 nm의 | 1.72 nm의 |
| 픽셀 수 | 8192 × 8192 | 1920 × 2560 | 3840 × 5120 | 2048 × 2048 |
| 가속 전압 | 1.0 kV | 3.0 kV | 7.0 kV | 120 kV |
| 획득 시간 | 2.5 시간 | 48 시간 | 4 시간 | 1 시간 |
결과 및 논의
전자현미경을 이용한 3차원 재구성 방법 비교
FIB-SEM, SBF-SEM(bulk sample 표면의 후방 산란 전자 이미지, 가속 전압은 각각 2kV 및 1.0kV), Array tomography(실리콘 웨이퍼에 장착된 얇은 단면 샘플의 후방 산란 전자 이미지, 가속 전압은 3.0kV), TEM 단층 촬영(얇은 단면 샘플의 투영 이미지, 기울기 없음, 가속 전압은 7.0kV). 벌크 시료의 표면 관찰을 위한 FIB-SEM 및 SBF-SEM은 영상의 선명도에서 얇은 부분 관찰을 위한 어레이 단층 촬영 및 TEM 단층 촬영에 비해 열등하였다(Fig. 120). 이는 이 샘플에서 대부분의 관찰 영역이 저전도성 수지로만 점유되어 있고 충전을 억제하기 위해 낮은 가속 전압으로 관찰해야 했기 때문이다. Array tomography의 화질은 TEM tomography와 동일합니다. 이 결과는 시료 전도도의 향상과 높은 가속 전압에서의 관찰이 SEM을 이용한 3차원 구조적 관찰에서 생물학적 시료를 관찰하는데 중요한 요소임을 시사한다(Fig. 3c). 또한 FIB-SEM과 SBF-SEM의 화질은 다른 두 방법에 비해 낮지만 파지 입자를 인식할 수 있는 해상도를 유지했다.
다음으로 3D 재구성 결과를 비교합니다. TEM 단층촬영에서 슬라이스의 두께(200 nm)는 직경보다 작습니다. E.coli (약 2 μm), 하나의 전체 이미지가 E.coli 3D로 재구성할 수 없습니다(그림 4d). 한편, SBF-SEM과 FIB-SEM은 대용량의 3차원 관찰에 성공하였다(Fig. 4a, b). 어레이 단층 촬영에서 XY 평면의 관찰 영역은 SBF 방법 및 FIB-SEM의 관찰 영역과 유사합니다. 그러나 본 연구에서는 준비된 슬라이스가 20개에 불과하기 때문에 관찰 체적의 두께가 감소하였다(Fig. 4c). 숙련된 기술과 긴 획득 시간이 필요했지만 대량 연속 단면을 준비하고 촬영한 현미경 사진의 수를 늘리면 3D 재구성 이미지의 두께를 늘릴 수 있다고 생각합니다. 하나 추출한 결과 E.coli 에 포함된 파지의 분할 및 E.coli 그리고 세포외막 E.coli , 우리는 의 형태를 인식할 수 있었다 E.coli 공간 해상도에 차이가 있지만(그림 3 eh) 모든 방법을 사용하여 파지의 4D 분포. 하나의 파지 입자에 초점을 맞추면, 파지 크기에 비해 Z 방향의 분해능이 충분하지 않기 때문에 SBF-SEM 및 어레이 단층 촬영에서 파지의 모양이 Z 방향으로 확장됩니다(그림 4i, k). FIB-SEM에서는 파지가 공 모양으로 재구성되었지만 TEM 단층 촬영 결과에 비해 3D 재구성 이미지의 세부 사항이 손실되었습니다(그림 4j, l). 비교 결과를 종합해보면, 의 형태학적 정량적 분석이 E.coli 및 파지 분포 분석 E.coli TEM 단층촬영은 파지와 같은 나노구조를 관찰하는데 필요한 높은 공간해상도를 제공하는 반면, SEM을 이용한 3차원 재구성 방법으로 수행할 수 있습니다. SBF-SEM 및 FIB-SEM에서 매우 유사한 결과가 얻어졌는데, 이는 시편 챔버에서 벌크 샘플을 슬라이싱하고 관찰하는 공통 기반을 가지고 있습니다. 본 연구에서는 SBF-SEM과 FIB-SEM에서 거의 동일한 부피를 얻었고, SBF-SEM의 획득 시간(2.5시간)은 FIB-SEM(20시간)에 비해 약 48배 빠른 획득 시간(표 1) ). 그러나 FIB-SEM은 SBF-SEM보다 높은 Z 해상도로 재구성된 3차원 구조 이미지를 제공했습니다. 이 해상도의 차이는 절단 두께의 차이로 인한 것입니다: FIB-SEM의 경우 20nm, SBF-SEM의 경우 50nm.
이러한 결과를 Table 2에 정리하였다. SBF-SEM의 화질은 다른 방법에 비해 열등한 반면 관찰영역의 넓은 범위와 관찰속도는 SBF-SEM과 비교할 수 없었다. 또한 전도도가 높은 샘플에서는 가속 전압을 더 높일 수 있으므로 이미지 품질이 향상됩니다. 위의 기능을 위해 SBF-SEM은 전도도가 높은 매우 큰 샘플과 포괄적인 분석에 적합합니다. 예를 들어, 조직 샘플은 크고 수지 면적이 작고 전도성이 높습니다. 커넥톰 분석에는 종합적인 분석이 필요합니다.
FIB-SEM은 SBF-SEM에 비해 긴 획득 시간이 필요하지만, FIB-SEM은 Z 해상도가 매우 높다는 장점이 있습니다. 이 이점은 좁은 관찰 영역에서만 유효합니다. FIB-SEM은 작은 샘플, 예를 들어 작은 조직 또는 하나의 전체 세포에 적합합니다. FIB-SEM은 높은 정량을 위해서는 높은 분해능이 필요하기 때문에 정량 분석에 높은 친화력을 가지고 있습니다. 또한 뼈와 금속을 절단할 수 있어 경조직 및 금속과 조직의 접촉부위를 3차원적으로 분석할 수 있다.
어레이 단층 촬영에서 샘플은 관찰 후에도 남아 있습니다. 한편, 관찰 가능한 깊이를 심화하려면 직렬 섹션과 긴 수집 시간을 만드는 성숙한 기술이 필요했습니다. 어레이 단층 촬영은 넓은 관찰 영역에서 희귀 현상을 자세히 분석하는 데 적합합니다. 우리는 유리와 같은 투명 기판이 상관광 및 전자 현미경(CLEM)을 포함한 다양한 상관 방법을 허용할 것으로 기대했습니다. 어레이 단층촬영은 시료 주변이 수지로 둘러싸여 있는 전도성이 낮은 부유 세포, 세균, 배아 관찰에 효과적입니다. 시료는 전도성 기판의 얇은 부분이기 때문에 대전이 억제되고 높은 가속 전압으로 시료를 관찰할 수 있습니다.
그림 3 각 방법의 관찰영역과 화질 비교.
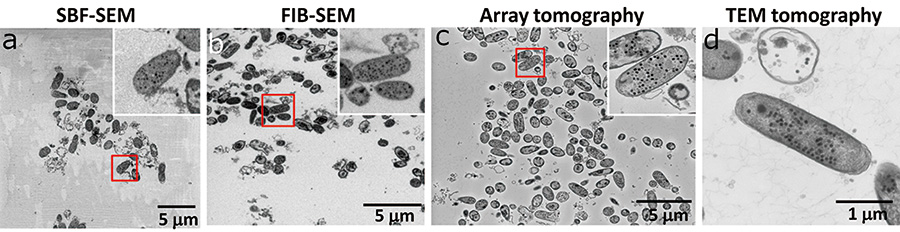
SBF-SEM에서는 도전성이 적은 블록 레진이 넓은 관찰영역을 차지하기 때문에 시편이 쉽게 대전되어 화질이 저하된다(a). FIB-SEM은 또한 넓은 블록 수지 영역을 관찰할 수 있지만 시료 표면을 스퍼터링한 갈륨 이온은 대전을 억제합니다(b). 어레이 단층 촬영에서는 전도성이 높은 실리콘 웨이퍼에 장착된 얇게 슬라이스된 섹션에 대해 대전이 억제되었기 때문에 높은 신호 대 잡음비(SN) 이미지를 관찰할 수 있었습니다(c). TEM 단층 촬영에서 우리는 하나만 관찰했습니다. E.coli (디).
그림 4 3D 재구성 결과 비교.

의 3D 구조를 재구성했습니다. E.coli T4 파지에 감염되었습니다. 전체 관찰 영역(광고)의 볼륨 렌더링 이미지. 하나의 분할 이미지 E.coli T4 파지(녹색)에 감염된 세포, E.coli (주황색) 및 감염 (분홍색) (eh). 한 T4 파지의 분할 이미지 E.coli (일).
표 2 전자현미경에 의한 3D 구조 분석의 특징 요약.
| SBF-SEM | FIB-SEM | 어레이 단층 촬영 | TEM 단층 촬영 | |
|---|---|---|---|---|
| 시야(X,Y) | 100μm 이상 | 1~100μm | 100μm | 5μm 미만 |
| 시야의 깊이(Z) | 매우 깊은 | 깊은 안마 | 폭이 좁은 | 매우 좁다 |
| 3D 해상도(Z) | 50 nm의 | 20 nm의 | 70 nm의 | 1 nm의 |
| 획득 시간 | 몇십년 우리 | 언젠가 | 언젠가 | 1~2시간 |
| 취득을 위한 노력 | 작은 | 작은 | 거대한 | 작은 |
| 최적의 샘플 | 조직, 뇌 | 조직, 배양 세포 | 조직, 배아, 배양세포 | 소기관, 바이러스 |
| 최적의 적용 | Conectome, 철저한 분석 | 형태 관찰, 정량 분석 | 정량분석, CLEM | 형태 관찰 |
3차원 재구성 영상 분석
① 형태의 관계 E.coli T4 파지와 내부 파지 입자에 감염
SBF-SEM은 의 형태를 분석하기에 충분했습니다. E.coli 및 T4 파지의 분포. 우리는 형태학의 관계를 분석했습니다. E.coli 및 SBF-SEM의 결과를 이용하여 내부 파지. 먼저 볼륨의 관계를 조사했습니다. E.coli 및 파지의 수(그림 5a). 결과는 하나의 내부 파지의 최대 수를 보여줍니다. E.coli 약 280개의 입자이며, E.coli 더 많은 파지 입자를 포함하는 것을 관찰할 수 있었습니다. 우리는 파지 입자의 수가 더 증가함에 따라 이러한 증가가 원인이 된다고 생각했습니다. E.coli 터지다. 함유된 파지 입자의 수는 부피가 증가함에 따라 증가하는 경향이 있습니다. E.coli 증가합니다. 그러나 이 관계는 선형이 아닙니다. 같은 부피에서도 파지 입자의 수에 차이가 있었다 E.coli (그림 5a의 B 및 C, D, E). 따라서 우리는 특성을 선택했습니다. E.coli (그림 5a, c의 AE). 선택된 E.coli 셀은 다음과 같습니다. 그것들은 부피가 작고 파지 입자가 거의 없습니다(그림 5a, c의 A, B). 다음 것들도 작은 부피였지만 많은 파지 입자를 가지고 있었습니다(그림 5a, c의 CE). 다른 것들은 부피가 크고 파지 입자가 많았다(도 5a,c의 F). E.coli 세포는 장축 방향으로 중앙부, 중간부, 측면부로 세 부분으로 나눴다. T4 파지 입자의 어느 부분이 국소화되어 있는지 분석했습니다(그림 5b). 파지 입자가 적을 때 대부분의 파지 입자는 중앙부에 국한되었다. 내부 파지 입자가 증가함에 따라 중앙부에 국한된 파지 입자는 중앙부에서 측부로 분산되었다. 또한, 볼륨으로 E.coli 증가할수록 중앙부의 파지 입자는 더 감소하였고 측면부에 국한된 파지 입자는 증가하였다. 다음으로 우리는 모양에 중점을 두었습니다. E.coli . 의 모양 E.coli T4 파지 입자가 거의 없는 것은 막대 모양이었다(그림 5c B). 내부 T4 파지 입자가 증가했을 때, E.coli 단축 방향으로 확장되어 모양이 배럴과 같은 모양이되었습니다(그림 5c CE).
그림 5 형태의 관계 E.coli 및 관련 파지.
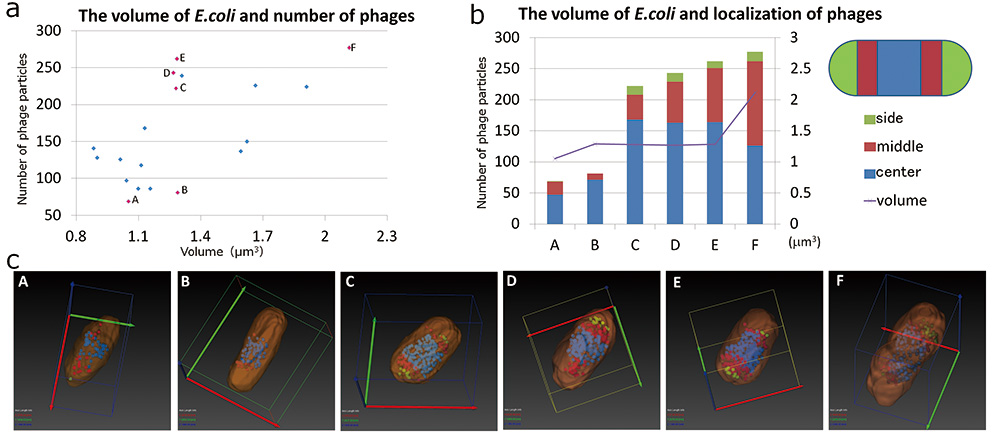
왼쪽 그래프는 부피의 관계를 보여줍니다. E.coli T4 파지에 감염된 T4 파지의 수(a). XNUMX가지 특성을 선택했습니다. E.coli 셀(왼쪽 그래프의 분홍색 점, AF). 이 6개의 형태 E.coli T4 파지를 포함하는 세포는 분할(c)에 의해 시각화되었으며, 오른쪽 그래프는 E.coli 및 T4 파지(b)의 분포.
② 파지의 종류와 파지 분포의 관계 E.coli
T4 파지는 SEM을 사용한 3D 구조 분석에서 강한 대조를 나타내므로 인식할 수 있습니다. E.coli . 그러나 λ 파지와 φ174 파지는 E.coli 대비가 낮았기 때문에 E.coli , 및 φ174 파지가 너무 작았습니다(그림 2 e, c, f). 따라서 의 비교 E.coli T4 phage, λphage, φ174 phage 감염은 Array tomography에 의한 3차원 재구성 영상을 이용하여 수행하였다. 먼저 우리는 형태학에 초점을 맞추었습니다. E.coli . 의 모양 E.coli λphage에 감염되면 막대 모양의 구조에서 공 모양의 구조로 변했습니다. 우리는 헤어졌다 E.coli 6개의 층으로 감염된 파지; 내층, 중간층, 외층으로 나누어 어떤 파지가 어느 층에 국한되어 있는지 조사하였다(Fig. 4a). 결과는 T174 파지와 φXNUMX 파지가 E.coli 그러나 편향 없이 거의 λ 파지 입자가 외층에 국한되어 있습니다. T4 파지 및 φ174 파지는 용해성 파지입니다. 에 감염되자마자 E.coli , 그들은 숙주 세포에서 증식하기 시작하고 숙주 세포가 파열(용해)합니다. 한편, λphage는 온대 파지이다. 그들이 감염되었을 때 E.coli 게놈을 숙주 세포에 주입하면 즉시 용해되지 않습니다. 감염 후, 그들은 자신의 게놈을 숙주의 게놈에 삽입하고 숙주의 일부로 행동합니다(리소겐화). 그러나 파지의 증식을 억제하는 리프레서는 환경의 변화에 의해 비활성화되어 파지가 증식을 시작하여 숙주가 용해된다. 관찰된 형태학적 변화와 파지의 국소화의 차이는 증식 부위에서 기인할 수 있으며, 용해성 파지는 감염 부위에서 즉시 증식하고 온대성 파지는 숙주 게놈에서 증식한다. φ174 파지는 6개의 층에서 편향된 분포를 나타내지 않았지만, 그들은 특정 부분(그림 XNUMXd). 이 실험에서는 첫 번째 감염 장소를 식별할 수 없었지만 지역화된 장소는 첫 번째 감염 장소와 관련이 있을 수 있습니다.
Fig.6 에서 파지의 3D 분포 E.coli
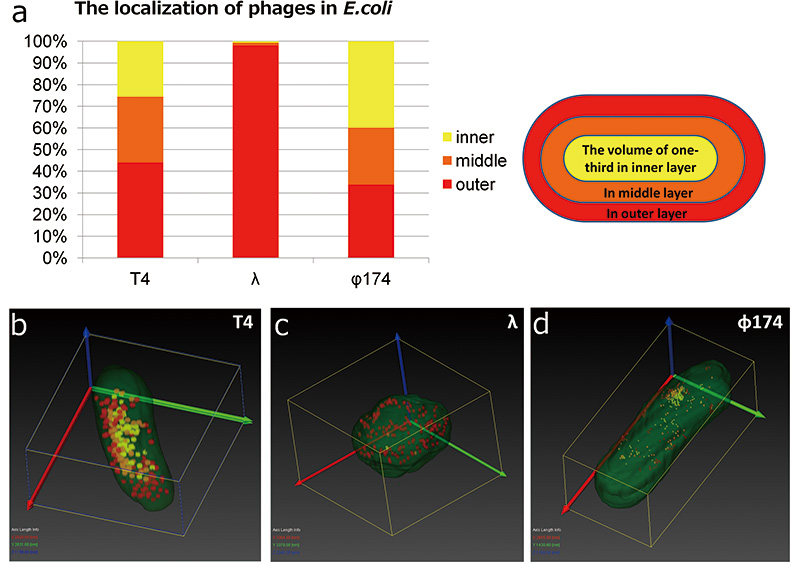
T3 파지, λ파지 및 φ4 파지 형태 어레이 단층 촬영의 174차원 구조 재구성 결과로부터 파지의 분포를 비교하였다. 우리는 헤어졌다 E.coli 세 부분으로; 내부 영역, 중간 영역 및 외부 영역을 측정하고 각 부분에 관여하는 파지의 수를 세었습니다. T4 파지와 φ174 파지는 분포 편향이 거의 없지만 거의 λ파지가 외부 영역(a)에 국한되어 있습니다. E.coli λphage에 감염된 것은 막대 모양에서 구형(c)으로 모양이 바뀌었다.
결론
SEM을 이용한 각 3D 재구성 방법은 샘플 준비 및 가속 전압과 같은 획득 조건에 따라 고유한 장단점이 있습니다. SBF-SEM 및 FIB-SEM에서는 데이터 수집이 자동으로 수행되는 반면, 세분화 분석 후 수동으로 수행되는 경우가 많습니다. 조직 및 관심 영역을 추출하는 분할은 이미지 대비를 기반으로 수행되는 경우가 많습니다. 그러나 생물학적 샘플은 대비에 약간의 차이가 있으며 때로는 대비만으로는 분할을 결정하지 못할 수 있습니다. 이미지의 고해상도를 유지함으로써 모폴로지를 랜드마크로 분할할 수 있어 분할 효율을 높이는 데 도움이 된다. SBF-SEM 및 FIB-SEM은 전용 기기를 도입해야 하는 반면 어레이 단층촬영은 기존 SEM 및 울트라마이크로톰으로 시작할 수 있지만 일부 기술이 필요합니다. 어떤 방법을 사용할 것인지 선택하는 것은 연구를 효율적으로 추진하기 위한 중요한 전략입니다. 본 논문이 전자현미경으로 3차원 분석을 시작하고자 하는 연구원들에게 도움이 되기를 바랍니다.
감사의
저자는 이 연구를 지원해 준 JEOL 관계자들에게 감사의 말을 전하고 싶습니다. H. 이 연구에서 경영진을 지원한 Nishioka, 어레이 단층촬영 데이터 수집 지원을 위한 M. Suga, FIB-SEM을 통한 데이터 수집 지원을 위한 H. Matsushima, SBF-의 유용한 토론과 기술 지도를 위한 Y. Yamaguchi SEM, K. Hasumi 세분화 지원. 저자는 또한 국립 기술 평가원, 국립 산업 과학 기술 연구소에 감사합니다. E.coli 및 파지.
참고자료
- Knott G, Marchman H, Wall D, Lich B. 집중 이온 빔 밀링을 사용한 성인 뇌 조직의 연속 단면 주사 전자 현미경. J 신경 과학. (2008).
- Micheva KD, 스미스 SJ. 어레이 단층 촬영: 신경 회로의 분자 구조 및 미세 구조를 이미징하기 위한 새로운 도구입니다. 신경. (2007).
- Deerinck, TJ & Bushong, Eric & Thor, A & Ellisman, Mark. 3D EM을 위한 NCMIR 방법: 직렬 블록 면 주사 전자 현미경을 위한 생물학적 표본 준비를 위한 새로운 프로토콜. Nat Center Microsc 이미지 해상도. 6-8. (2010).
- Denk W, Horstmann H. XNUMX차원 조직 나노구조를 재구성하기 위한 직렬 블록면 주사 전자 현미경. PLoS Biol. (2004).
- Schindelin J, Arganda-Carreras I, Frize E, Kaynig V, Longair M, Pietzsch T, Preibisch S, Rueden C, Saalfeld S, Schmid B, Tinevez JY, White DJ, Hartenstein V, Eliceiri K, Tomancak P, Cardona A. 피지: 생물학적 이미지 분석을 위한 오픈 소스 플랫폼. Nat 메서드. (2012).
