전자 냉동현미경의 기술개발 및 생명과학에의 공헌
절뉴스 Vol.53 No.3
난바 케이이치 & 카토 타카유키
오사카대학 프론티어 바이오사이언스 연구과
생물학적 거대분자와 그 복합체의 XNUMX차원 구조는 생명과학뿐만 아니라 의학 및 약물 설계를 위한 기본 정보입니다. 전자저온현미경은 지금까지 기본 기술로 사용되던 X선 결정학 및 NMR과 더불어 고해상도 구조 분석을 위한 강력한 도구로 많은 주목을 받고 있습니다. 상대적으로 낮은 수준의 전자 조사에도 쉽게 손상되는 생체 분자 구조를 원래 상태에서 원자 수준의 분해능으로 이미지화하고 분석할 수 있는 방법은 무엇입니까? 이 논문은 전자 저온현미경에 대한 우리의 자체 기술 개발의 역사와 현재 상태, 그리고 향후 개발에 따른 미래의 기대와 전망을 설명합니다.
개요
2017년 노벨 화학상은 전자 개발의 선구적인 업적을 인정받은 Jacques Dubochet(스위스 로잔 대학교), Joachim Frank(미국 컬럼비아 대학교), Richard Henderson(영국 MRC 분자 생물학 연구소)에게 수여되었습니다. 단백질 및 핵산과 같은 생물학적 거대 분자의 구조 분석을 위한 저온 현미경 및 이미지 분석. 생체분자의 3차원(XNUMXD) 구조는 생명과학뿐만 아니라 의학 및 의약품 설계에 있어 기본적이고 중요한 정보이며, 전자저온현미경(cryoEM)은 과거 고해상도 구조 분석을 위한 강력한 도구가 되었습니다. X선 결정학 및 NMR과 더불어 구조 분석의 필수 기술 중 하나로 자리 잡았습니다. 전자저온현미경은 결정화 과정 없이 수십 μg 정도의 아주 적은 양의 용액 시료만으로도 구조 분석에서 원자 수준의 분해능을 얻을 수 있어 많은 주목을 받고 있다. 노벨상은 이 기술의 창시자로서 위의 세 명의 연구원의 공헌을 인정하기 위해 수여되었습니다. 여기서는 구조생물학을 위한 기술로서 전자저온현미경과 영상분석의 개념, 자체 기술발전의 역사와 현황, 그리고 이 기술이 향후 발전을 통해 생명과학 및 의학분야에 미칠 미래의 가능성에 대해 설명한다.
전자저온현미경에 의한 생물학적 거대분자의 구조 분석
생물학적 활동을 추진하고 지원하는 기본 메커니즘은 박테리아 및 효모와 같은 미생물에서 동물 및 식물과 같은 다세포 유기체, 그리고 고차 뇌 기능을 가진 인간에 이르기까지 다양한 유기체에 의해 공유됩니다. 이러한 모든 기능은 수천에서 수만에 이르는 수많은 원자의 3차원 배열을 가진 단백질과 핵산의 구조를 기반으로 결정됩니다. 또한 그 구조는 금속 및 세라믹과 같은 벌크 재료처럼 단단하지 않고 매우 역동적이고 유연하며 열 변동을 능동적으로 활용하여 기능하도록 설계되었습니다. 생명 과학의 주요 과제 중 하나는 이러한 기능을 결정하고 발현하는 메커니즘의 해명이며 다양한 생물학적 기능에 관여하는 다양한 상태의 수많은 생물학적 거대 분자의 3D 구조를 살펴볼 필요가 있습니다. 해결해야 하는 3D 구조의 수는 수십만에서 수백만에 이릅니다.
cryoEM, 특히 단일 입자 이미지 분석의 강력한 기능은 X-선 결정학에 필수적인 시료 결정화가 필요하지 않으며 NMR과 달리 분자 복합체 크기의 상한이 거의 없다는 것입니다. 그러나 3차원 구조를 유지하는 원자간 결합의 대부분은 수소 결합, 염다리, 반 데르 발스 접촉과 같은 비공유 결합이기 때문에 구조가 전자빔 조사 손상에 매우 민감하여 몇 배 더 나빠집니다. 금속, 세라믹, 반도체보다 따라서 생물학적 거대분자의 고해상도 이미지를 큰 손상 없이 그대로 기록하기 위해서는 수용액을 급속 동결시켜 비정질 얼음 박막에 매립하고 투과전자저온현미경(cryoTEM)으로 이미지를 기록해야 한다. 액체 헬륨 또는 액체 질소에 의해 유리체 얼음이 결정 상태로 전환되는 것을 방지하기에 충분히 낮은 온도로 냉각된 시편 단계. 이러한 낮은 온도에서도 원자 수준 구조에 큰 손상을 주지 않고 조사할 수 있는 전자 선량은 20~30e로 제한됩니다.-/Å2 등으로 cryoEM 이미지는 이미지 디텍터의 각 픽셀에서 검출되는 전자의 수가 상대적으로 적기 때문에 발생하는 고유한 통계 노이즈와 큰 분포로 인해 발생하는 Landau 노이즈로 인해 매우 불량한 경향이 있습니다. 개별 전자 검출의 신호 수준. cryoTEM에 의해 기록된 개별 분자 이미지는 다양한 방향으로 비정질 얼음 필름에 내장된 분자의 2D 투영 이미지이기 때문에 재구성을 위해 균일한 분포로 서로 다른 방향을 커버하기에 충분한 많은 수의 이미지를 수집해야 합니다. 고해상도의 3D 이미지. 따라서 최대한 많은 분자영상을 효율적으로 수집하여 투영 방향별로 분류하고 분자영상의 위치와 방향을 정렬하여 각 방향에 대한 평균 영상을 얻어 노이즈를 줄이면서 신호 레벨을 높이는 것이 필수적이다. . 이 절차를 2D 클래스 평균이라고 합니다. 그런 다음 투영 방향에서 2D 클래스 평균 이미지 간의 상대적 관계를 결정하고 최종적으로 분자의 3D 이미지를 재구성할 수 있습니다(그림 1). 고해상도 구조 분석을 달성하려면 고품질, 고해상도 cryoEM 이미지를 효율적으로 수집할 수 있는 cryoTEM 및 이미지 검출기를 사용하는 것이 중요합니다. 고정밀 이미지 분석 프로그램과 고속 컴퓨터도 필요합니다. 이러한 문제를 해결하기 위해 자체적으로 cryoTEM 시스템을 개발한 역사와 이를 사용하여 일부 성과를 설명합니다.
그림 1 단일 입자 이미지 분석 과정을 설명하는 개략도.
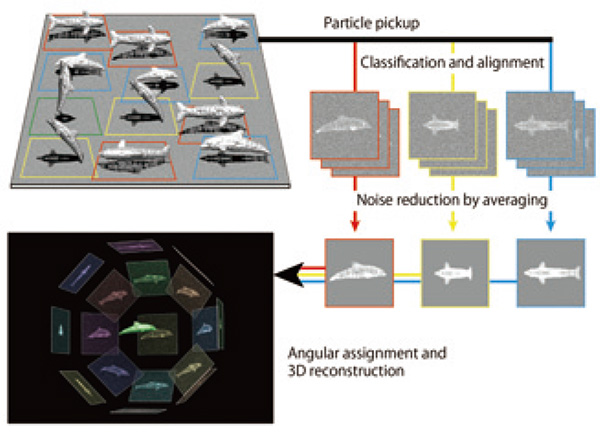
돌고래는 다양한 방향으로 얇은 유리질 얼음 필름에 내장된 생체 분자를 나타냅니다. CryoEM 이미지는 노이즈 수준이 높은 2D 프로젝션에 해당합니다. 2D 분류와 많은 2D 프로젝션의 평균을 거쳐 S/N을 크게 높인 후 3D 이미지를 재구성할 수 있습니다.
cryoTEM, 이미지 검출기 및 데이터 수집 및 분석 방법의 발전
전계 방출 전자총
일본 cryoEM 분야의 선구자는 Yoshinori Fujiyoshi(나고야 대학 객원 교수)입니다. 그는 JEOL과 공동으로 세계 최초로 매우 안정적인 액체 헬륨 냉각 시편 스테이지를 갖춘 cryoTEM을 설계 및 개발하여 전자빔 조사 손상을 극한까지 최소화하여 고품질의 생물체 cryoEM 이미지를 기록할 수 있습니다. 거대분자 [1]. 나는 1990년경부터 그와 협력하여 박테리아 편모 필라멘트의 구조 분석을 위한 전자 저온현미경을 사용하여 조립 및 슈퍼코일링 메커니즘을 이해하기 시작했습니다. 그 당시에는 전자 저온현미경으로 달성할 수 있는 분해능이 다소 제한적이었기 때문에 X선 섬유 회절과 X선 결정학을 사용했지만 고해상도 구조를 위한 액체 헬륨 냉각 표본 스테이지가 있는 cryoTEM의 가능성을 인식했습니다. 분석. 그는 cryoEM 그리드 준비에서 냉동 수화 얼음 내장 단백질 복합체의 최소 선량 이미징에 이르기까지 cryoEM 기술의 기초를 가르쳤습니다. 그리고 약 XNUMX년 후 Panasonic(Matsushita Electric Industrial Co., Ltd. 당시) 파나소닉이 KeiHanNa 사이언스 시티에 기초 연구 중심의 새로운 R&D 센터로 설립할 계획이었던 첨단 기술 연구소의 한 분과에서 저만의 연구소를 시작했습니다. 하위 부서는 IIAR(International Institute for Advanced Research)라고 불렸으며 X선 구조 분석 및 전자 저온 현미경 검사를 위한 새로운 장비 개발을 위한 넉넉한 자금 지원을 약속받았습니다. 그래서 저는 Yoshinori Fujiyoshi에게 이 새로운 Panasonic 연구소에 합류하여 고급 구조 생물물리학 연구 센터로서 IIAR을 함께 시작할 것을 요청했습니다. 위에서 언급한 액체 헬륨 냉각 표본 스테이지가 있는 cryoTEM에 새로 개발된 장치인 쇼트키형 전계 방출 전자총(Thermal FEG)을 도입하도록 JEOL에 요청했습니다. 이것은 FEG가 있는 최초의 cryoTEM이었으며 JEM-3000SFF(Generation 3: G3)로 명명되었습니다(그림 XNUMX). 2) [1]. Panasonic은 1994년에 새로운 KeiHanNa 연구소를 설립했고, 우리는 새 건물로 이사하여 이 새로운 cryoTEM으로 실험실을 세웠습니다. 전계 방출에 의한 전자빔의 높은 결맞음으로 EM 이미지의 품질과 해상도가 크게 향상될 것으로 기대했습니다. 우리가 수집한 모든 cryoEM 이미지에서 훨씬 더 높은 해상도의 신호를 보여줌으로써 실제로 놀라운 개선이 이루어졌습니다. Fujiyoshi 그룹은 XNUMX차원 결정에서 박테리오로돕신 및 아쿠아포린과 같은 막 단백질의 구조를 해결하는 것을 목표로 했으며, 우리 그룹은 세균의 편모 필라멘트와 같은 거대 분자의 대형 나선형 조립체 구조를 분석하는 것을 목표로 했습니다. 당시에는 사진 필름만 이미지 검출기로 사용할 수 있었기 때문에 고품질 이미지 데이터 수집의 효율성과 처리량이 매우 낮았습니다. 그래서 구조 분석이 거의 원자 분해능에 도달하는 데 몇 년 이상이 걸렸지만 2000년대 중반에 막 단백질 2D 결정 및 거대 분자 복합체의 원자 분해능 구조로 많은 영향력 있는 결과를 얻을 수 있었습니다[2-6 ]. 박테리아 편모 필라멘트의 구조 분석은 단지 4개 플라젤린 분자에 해당하는 필라멘트의 고도로 선택된 고품질 cryoEM 이미지의 신중한 이미지 분석을 통해 40,000Å에 가까운 해상도를 달성했으며 폴리펩티드 백본 접힘 및 큰 측쇄가 명확하게 해결되었습니다. (무화과.
그림 2 우리 그룹에서 cryoTEMs의 개발 역사.

새로 편입된 원소 기술 및 장비는 빨간색 문자로 표시됩니다.
그림 3 cryoEM 이미지 분석으로 드러난 편모 필라멘트의 분자 구조.
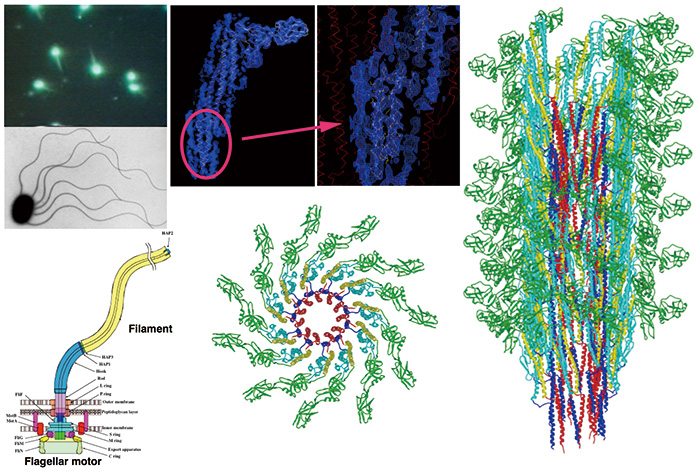
박테리아 편모는 회전 모터와 나선형 필라멘트 프로펠러가 있는 운동 소기관입니다. 편모 필라멘트는 수만 개의 플라젤린 분자로 이루어진 커다란 나선형 집합체입니다. JEM-3000SFF cryoTEM과 사진 필름을 이미지 검출기로 사용하여 cryoEM 이미지를 수집하고 약 4Å 해상도에서 편모 필라멘트의 구조를 해결했습니다. 생체분자의 cryoEM 이미지 분석을 통해 처음으로 메인 체인 폴딩과 많은 대형 사이드 체인이 명확하게 시각화되었으며, 이를 통해 이 거대한 단백질 어셈블리의 완전한 원자 모델을 구축할 수 있었습니다.
CCD 카메라와 Ω형 에너지 필터
2002년에 오사카대학에 프론티어 생명과학연구과를 개설하고 2004년에 연구실을 나노생물학관으로 이전했습니다. 그 직전에 추경예산의 일환으로 문부과학성으로부터 국비를 확보하여 JEOL에 도입을 의뢰했습니다. 액체 헬륨 냉각 시편 스테이지가 있는 cryoTEM에 새로 개발된 장치의 커플. 이것은 JEM-3200FSC(그림 2)로 SPring-4 사이트의 Riken Harima 연구소에 도입된 Fujiyoshi의 1세대 cryoTEM(G8) [7]의 개선된 버전입니다. 새로운 장치 중 하나는 In-column Ω형 에너지 필터의 개선된 버전이었으며, 이는 비탄성적으로 산란된 대부분의 전자를 제거하여 cryoEM 이미지의 신호 대 잡음비(S/N)를 개선하기 위해 도입되었습니다. 에너지 손실로 인한 일관성은 높은 배경 잡음에만 기여하고 고해상도 EM 이미지에는 기여하지 않습니다. 우리는 이 에너지 필터에 의해 이미지 S/N이 거의 4배 향상됨을 발견했습니다[4]. 또 다른 장치는 415K × 7K CCD 이미지 검출기(TVIPS F4MP)로 이미 전자 회절 기록에 사용되었지만 사진 필름보다 분해능이 낮아 이미징에는 사용되지 않았습니다. EM 이미지를 형성하는 각 전자는 유리 섬유 결합 블록 위에 있는 얇은 신틸레이터 층에 의해 광자로 변환되어야 하고 각 전자의 이미지는 섬광체 내 전자 산란에 의해 흐려지기 때문에 분해능이 낮습니다. 이러한 단점에도 불구하고 CCD는 노출 직후 EM 이미지와 푸리에 변환을 볼 수 있기 때문에 고품질 이미지 데이터 수집의 효율성과 처리량을 크게 향상시켰습니다. 데이터 수집 중 개별 cryoEM 이미지의 해상도 [50]. 또한 In-column 탱크에서 Top-Entry 시편 포드로의 액체 헬륨 공급을 중단하여 시편 온도를 4K에서 약 50K로 증가시켜 고품질 이미지 데이터 수집의 효율성을 더욱 향상시킬 수 있었습니다. 방사선 손상은 7K에서 최소화할 수 있지만, 대부분의 cryoEM 이미지는 극히 낮은 온도에서 얇은 시편 얼음막의 전기 전도도가 매우 낮기 때문에 전자빔 조사 시 전하가 증가하여 국부적으로 편향된 이미지 블러링이 발생했습니다. 온도. 이미지 분석에 사용할 수 있는 수집된 이미지는 몇 % 미만이었습니다. 우리는 시편 온도를 약 XNUMXK로 높여 이 어려운 문제를 해결했고 수집된 거의 모든 이미지는 이미지 분석에 사용할 수 있을 만큼 충분히 높은 품질이 되었습니다[XNUMX].
이러한 기술적 개선 및 발전으로 이전에는 데이터 수집에서 3D 이미지 재구성에 이르기까지 몇 주 내에 완료되는 다년간의 프로젝트가 이루어졌으며 박테리아 편모 후크, 근육 액틴 필라멘트, 박테리아 세포 분열을 위해 플라스미드를 분리하는 ParM 필라멘트, 병원성 박테리아의 독성 유형 III 분비 시스템의 얇은 침관 및 아토미오신 경직 복합체, 모두 5 - 7 Å 해상도에서. 우리는 사용 가능한 결정 구조를 3D 맵에 도킹하고 정제함으로써 기능 메커니즘에 대한 통찰력을 얻기 위해 신뢰할 수 있는 원자 모델을 구축할 수 있었습니다[7-12]. 담배 모자이크 바이러스 코트 단백질에 의해 형성된 스택 디스크의 구조는 많은 측쇄를 시각화할 수 있도록 3.8주 이내에 XNUMXÅ 분해능으로 해결되었습니다(Takashi Fujii, 미공개).
측면 입구 액체 헬륨 냉각 스테이지
1980년대에 Fujiyoshi가 개발한 액체 헬륨 냉각 시편 스테이지는 최상위 항목 유형이었습니다. 기계적으로는 매우 안정적이었지만 스테이지에 틸팅 메커니즘이 없었기 때문에 전자 냉동 단층 촬영을 할 수 없었습니다. 고해상도 2D 이미지 재구성을 위해 3D 푸리에 공간의 대부분을 커버하기 위해 다양한 기울기 각도에서 3D 결정을 이미징하기 위한 특별한 장치가 만들어졌지만 여전히 시간이 많이 소요되었습니다. 그래서 Fujiyoshi는 틸팅 메커니즘을 구현하기 위해 자신의 최상위 진입 단계를 재설계하기로 결정하고 JEOL의 개발을 위해 과학 기술 진흥을 위한 특별 조정 기금이라는 문부과학성 예산을 신청했고, 저는 공동 제안자로 이 프로젝트에 참여했습니다. 이 프로젝트에서 개발된 것은 Generation 6(G6)의 cryoTEM입니다(그림 2). JEOL은 2006개를 제작하여 1년에 교토 대학과 오사카 대학에 납품했습니다[3]. 우리의 주요 연구 주제 중 하나는 박테리아 수영 운동성을 위한 추진력을 생성하기 위해 헬리컬 프로펠러로 슈퍼코일된 편모 필라멘트를 회전시키는 박테리아 편모 모터입니다. 우리는 모터 회전 메커니즘을 이해하기 위해 세포막에 걸친 편모 기저체의 상세한 구조 정보가 필요하지만 고정자 단위와 같은 모터의 중요한 구성 요소는 세제 용해에 의한 분리 및 정화 중에 기저체에서 분리됩니다. 결합력이 약하기 때문에 편모 모터의 구조는 세포에서 분리되었을 때 기능 상태에서 관찰할 수 없습니다. 그래서 우리가 이 새로운 cryoTEM으로 하려는 목표는 세포 내부의 생체분자 복합체의 in situ 구조를 관찰하기 위한 전자 저온촬영법(ECT) 방법을 확립하는 것이었습니다. 우리는 표본 그리드에서 전체 박테리아 세포를 빠르게 동결하여 세포막의 기능적 모터 구조를 시각화하고 많은 기울기 이미지를 기록하여 세포의 1D 이미지를 재구성하는 기울기 메커니즘이 있는 이 새로운 cryoTEM으로 ECT 방법을 확립하려고 했습니다. 편모 기저체와 함께. 그러나 살모넬라 세포의 직경은 거의 60 μm 두께이고 전자빔이 통과하는 시편 두께는 300º 기울기에서 두 배로 두꺼워지기 때문에 13 keV 전자가 통과하고 탄력적으로 산란하여 EM을 형성하기에는 너무 두껍습니다. 좋은 품질의 이미지를 얻기 위해 우리는 야생형보다 살모넬라 세포를 훨씬 더 작게 만드는 "미니 세포"를 생산하는 유전 공학 기술을 도입할 때까지 기저체의 제자리 구조를 시각화하기 위해 몇 년을 기다려야 했습니다[XNUMX ].
단일 입자 이미지 분석을 위한 이미지 데이터 수집의 효율성과 처리량을 더욱 향상시키기 위해 우리는 2011년에 컴퓨터 제어에 의해 자동 데이터 수집이 가능하도록 시편 스테이지를 JEOL의 독창적인 디자인의 사이드 엔트리 유형으로 변경하기로 결정했습니다. . cryoTEM의 수정된 버전은 G6N(새로운 수정이 포함된 6세대)입니다(그림 2).
다른 유형의 대물렌즈 폴 피스와 함께 이 표본 스테이지를 도입함으로써 기대 이상의 사용성과 이미지 해상도가 향상되었습니다. cryoTEM의 가능한 가장 높은 이미지 해상도를 검사하는 표준 방법 중 하나는 비정질 백금-이리듐(Pt/Ir) 합금 박막과 같은 테스트 시편의 EM 이미지를 약 Thon 링이 얼마나 멀리 확장되는지 확인하려면 푸리에 변환을 살펴보십시오(그림 1 참조). 이것은 냉동 수화 얼음 내장 표본의 cryoEM 이미지 해상도를 검사하기 위해 일상적으로 수행하는 작업이며 이미지 분석을 위해 얼음 내장 생체 분자를 볼 수 있도록 저해상도의 이미지 대비를 향상시키기 위해 이러한 큰 디포커스가 필요합니다. 얇은 합금 필름을 사용함으로써 가능한 가장 높은 분해능에서 약한 톤 링 신호를 보기 위해 방사선 손상을 피하기 위해 사용해야 하는 낮은 전자 선량에 의해 제한되지 않습니다. cryoTEM G4N의 설치 완료일에 수행된 이러한 이미지 해상도 테스트를 통해 Thon 링이 6Å 해상도 이상으로 확장되는 것을 볼 수 있었습니다. Thon 링이 이러한 디포커스 조건에서 가능한 최고의 해상도로 확장되도록 하려면 cryoTEM의 전자 광학 시스템이 시편에 평행 조명 빔을 생성하도록 설정되어야 합니다. 다행스럽게도 이 cryoTEM의 대물 렌즈 폴 피스가 사용자가 평행 조명 조건을 의식하지 않고 이미지를 수집하도록 설정한 거의 모든 이미징 조건에서 이러한 요구 사항을 충족하도록 설계되었습니다.
그러나 몇 가지 다른 문제가 있었습니다. 시편 스테이지는 액체 헬륨 냉각이지만 시편 온도는 G4 top-entry 유형보다 약간 높았고 G50 top-entry 유형에서와 같이 온도를 4K까지 올릴 수 없었습니다. 또한 전 세계적으로 헬륨 공급이 제한되어 가격이 상승했습니다. 당사 현미경 설비는 같은 캠퍼스 내 오사카대학 저온센터에 헬륨회수관으로 연결되어 있었는데 헬륨회수관이 공기오염으로 저온센터 운영에 자주 문제를 일으켰습니다. 그래서 2012년 즈음에 액체 헬륨 사용을 중단하기로 했습니다. cryoTEM G6N의 액체 질소 탱크와 액체 헬륨 탱크 모두에 액체 질소를 채우고 시료 온도를 77K로 안정적으로 유지할 수 있음을 확인했습니다. 정확히 액체 질소 온도입니다. 7~8시간 동안. TVIPS에서 제공하는 CCD 카메라 제어 소프트웨어를 최대한 활용함으로써 거의 자동화된 데이터 수집이 가능해졌으며 이는 cryoEM 이미지 데이터 수집을 매우 효율적으로 만들었습니다.
그림 4 프로토타입 CRYO ARM™으로 기록된 Pt/Ir 박막 이미지의 Thon ring.
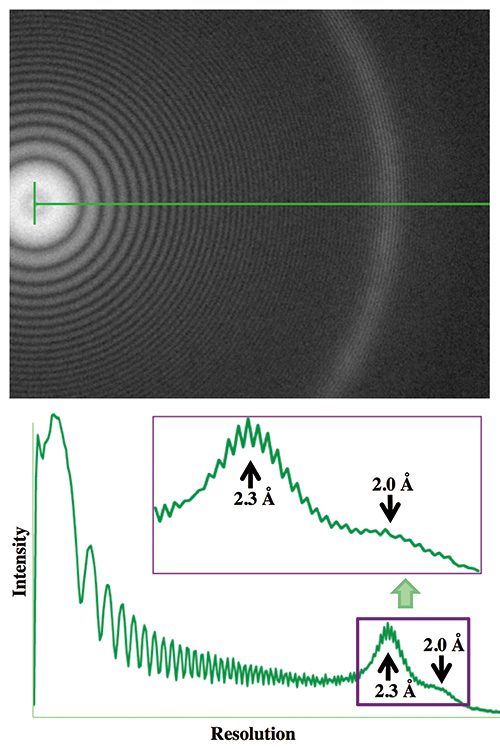
Pt/Ir 박막의 cryoEM 이미지는 1kV에서 작동하는 프로토타입 CRYO ARM™으로 200μm 디포커스에서 촬영되었습니다. 푸리에 변환의 Thon 링은 1.8Å 분해능으로 확장되었습니다.
CMOS 기반 직접 전자 검출기 카메라
마지막으로 2013년 CMOS 기반 직접 전자 검출기 카메라가 등장하면서 cryoEM 분야의 전성기가 찾아왔습니다. 샌프란시스코 캘리포니아 대학의 David Agard와 그의 동료들은 주요 EM 카메라 제조업체 중 하나인 Gatan과 공동으로 EM 이미지 검출기를 개발하고 있었습니다. 캘리포니아 대학교 버클리. Gatan은 이 카메라 시스템의 개발을 완료하고 2013년 K2 Summit으로 상용화했습니다. CMOS 이미징 칩은 4K x 4K 픽셀로 300keV 이상으로 가속된 고에너지 전자의 직접 조사에 강하고 매우 얇은 전자 검출 반도체 내에서 전자 산란으로 인한 이미지 블러를 최소화하는 놀라운 사양을 가졌습니다. 그리고 무엇보다 16만 화소 이미지의 데이터 획득 속도가 초당 400프레임으로 단일 전자 계수가 가능했다. cryoEM 이미지 기록에 일반적으로 사용되는 총 전자 선량은 20~30e이기 때문에-10초의 노출 시간 동안 노출 시간을 10배 길게 만들어 선량률을 약 XNUMX배 낮추면 각 프레임당 검출기 평면에 들어오는 전자의 수가 제한되고 셀 수 있습니다. 단일 전자 계수는 이미지 노이즈 수준을 줄이는 데 큰 이점을 제공합니다. cryoEM 이미지 기록의 주요 노이즈 소스 중 하나는 방사선 손상을 피하기 위한 저선량 이미징으로 인해 개별 cryoEM 이미지를 형성하는 전자의 수가 적기 때문에 신호에 비해 상대적으로 큰 통계적 노이즈입니다. 그것에서 벗어날 방법이 없습니다. 그러나 단일 전자 계수는 CCD와 같은 모든 유형의 에너지 축적 이미지 검출기가 개별 전자 검출을 위해 생성하는 신호 진폭의 큰 분포로 인해 발생하는 검출기 고유 노이즈인 Landau 노이즈를 최소화할 수 있습니다.
샌프란시스코 캘리포니아 대학의 Yifan Cheng은 이 CMOS 카메라 시스템의 성능을 최대한 활용하고 동영상 모드 이미징 및 동작 보정을 통해 단백질의 선명한 고품질 cryoEM 이미지를 수집하는 방법을 고안했습니다. 그와 그의 동료들은 동료 그룹의 많은 노력에도 불구하고 수년 동안 결정화를 피한 소량의 용액 샘플에서 열과 매운맛을 감지하는 막 단백질 TRPV3 수용체 이온 채널의 1차원 구조를 성공적으로 분석했습니다. , 2013년 말에 Nature에 14편의 논문을 발표했습니다[15, 3.4]. 세제로 가용화된 단백질을 함유한 소량의 시료 용액에서 얻은 약 100,000개의 cryoEM 이미지에서 얻은 약 1,000개의 단백질 단일 입자 이미지를 분석하여 80Å 해상도에서 구조를 풀었다. 단일 전자 계수를 위한 개별 프레임 처리 후 5프레임마다 합산하여 초당 16프레임의 cryoEM 동영상을 만든 다음 이 동영상 프레임을 모션 보정으로 합산하여 표본 스테이지의 기계적 드리프트로 인한 이미지 흐림을 최소화하고 최종 cryoEM 이미지를 매우 선명하게 만들기 위해 전자 조사로 인한 얼음 필름의 왜곡[XNUMX].
우리는 2년에 당사의 cryoTEM G6N(그림 2)에 Gatan K2015 Summit을 도입할 수 있었고 이미지 검출기로 고성능을 활용하려고 했습니다. 영화 모드 이미지 기록을 통해 막 단백질을 포함한 다양한 생체 분자의 구조를 원자 수준에 가까운 해상도로 캡처할 수 있었으며, 우리가 달성한 최고 해상도는 Shigella type III 독성 인자 분비 시스템의 가는 침관 구조에 대해 2.7Å이었습니다. (후지이 다카시 & 야마다 유리카, 미공개). 달성 가능한 분해능은 시료 분자의 구조적 안정성과 cryoEM 그리드의 얼음 박막 두께에 크게 좌우되기 때문에 더 나은 시료와 그리드로 2.0Å를 초과하는 분해능을 달성하는 것이 가능해야 합니다.
CRYO ARM™ 개발
전자 현미경의 주요 제조업체 중 하나인 FEI 회사(2017년부터 Thermo Fisher Scientific)는 1990년대 말부터 생명 과학 연구원을 위한 고성능 사용자 친화적 cryoTEM 개발을 시작했으며 2004년 Polara라는 cryoTEM을 생산했으며 Titan Krios를 생산했습니다. Titan Krios는 특히 사용자 친화적인 시스템으로 매거진에 2008개의 cryoEM 그리드를 저장할 수 있어 사용자가 자동 로딩 장치(오토로더)를 통해 액체 질소로 약 12K로 냉각된 시편 스테이지에 각 그리드를 로드할 수 있습니다. 사용자가 그리드의 품질을 판단한 후 이미지 기록을 위한 영역을 지정하여 자동화된 이미지 데이터 수집이 가능합니다. Titan Krios는 ECT에 의한 세포 구조의 90차원 관찰과 단일 입자 이미지 분석 모두에서 많은 cryoEM을 필요로 하기 때문에 높은 해상도와 사용자 편의성을 달성하는 높은 성능으로 전 세계 cryoEM 분야의 많은 사용자들로부터 높은 평가를 받고 있습니다. 수집할 이미지 데이터.
JEOL은 200년 재료 연구용 고해상도 TEM으로 JEM-ARM2009F(ARM: Atomic Resolution Microscope)를 개발해 세계적으로 높은 평가를 받았다. 그래서 JEOL은 고분해능 전자광학의 성능을 극대화할 수 있는 고도로 안정적인 컴퓨터 제어 액체 질소 냉각 시편 스테이지와 같은 필수 장치를 개발하여 초고해상도 전자광학을 활용한 ARM 기반 cryoTEM을 개발해야 한다고 생각했습니다. , Titan Krios보다 사용자 친화적이고 사용하기 편리한 cryoEM grid autoloader와 액체 질소 자동 충전 시스템, 그리고 Ω-type in-column 에너지 필터를 추가하여 비탄성 산란 전자를 최소화 녹화된 이미지의 S/N을 높입니다. Ω-필터는 또한 EM 그리드의 품질 평가 및 판단을 위해 얼음막의 두께를 빠르게 측정하는 데 유용합니다. 적시에 JSPS는 최첨단 연구 인프라 구축 프로그램이라는 대규모 자금 지원을 발표했으며, Riken Quantitative Biology Center(QBiC)의 이사인 Toshio Yanagida가 자금 지원을 제안하고 신청했습니다. 오사카 대학 명예교수 겸 정보 및 신경망 센터 소장)은 Riken QBiC 설립 준비를 위해 2010년에 승인되었습니다. 이 예산은 공동 연구 활동을 위해 Riken과 오사카 대학에 할당되었습니다. 예산의 일부를 사용자 친화적인 고해상도 cryoTEM 개발에 사용할 것을 제안했고 JEOL에 개발을 요청하는 승인을 받았습니다. 우리는 JEOL의 기술팀에 우리의 아이디어, 비전 및 요구 사양을 전달했고 그들은 개발을 시작하기로 동의했습니다. JEOL은 2014년 봄까지 프로토타입 cryoTEM을 완성할 계획이었고, 우리는 많은 회의를 통해 많은 논의를 거듭했습니다. 이 새로운 cryoTEM의 별명은 CryoARM이었고 JEOL은 이를 CRYO ARM™이라고 명명했습니다(그림 2). 우리가 설정한 목표 중 하나는 생체 분자 복합체의 구조 분석에서 달성 가능한 분해능으로 2.0Å를 초과하는 것이었습니다.
여러 사정과 사정으로 개발이 지연되었으나 2016년 200월 Nanobiology 건물에 cryoTEM 시제품이 드디어 설치되었습니다. 아직 Cold FEG를 사용할 수 없었던 당시에 만들어진 초기 설계 계획에 따라 이 프로토타입 CRYO ARM에는 가속 전압이 1kV인 Thermal FEG가 설치되었습니다. 우리는 1.8μm 디포커스에서 기록된 Pt/Ir 박막 이미지의 푸리에 변환에서 Thon 링을 검사하고 Thon 링이 4Å 해상도 이상으로 확장됨을 확인했습니다(그림 2017). 우리의 중요한 임무는 이 시점에서 시작되었습니다. 우리는 해상도에 대한 cryoTEM의 성능을 평가하기 위해 단일 입자 이미지 분석으로 구조를 분석하기 위해 다양한 생체 분자 표본의 cryoEM 그리드를 준비하고 cryoEM 이미지를 수집했습니다. 우리는 또한 cryoTEM 작동 및 제어 소프트웨어의 사용자 친화성, cryoEM 그리드 전송을 위한 cryo-workstation을 사용한 수동 작동의 신속성과 부드러움, 오토로더 작동, 자동 이미지 기록에 의한 데이터 수집 및 자동 데이터 수집 소프트웨어 JADAS에서 완전 자동화된 데이터 수집을 위해 개선해야 할 사항을 JEOL 엔지니어에게 피드백합니다. 우리가 예상한 대로 자동 로더와 크라이오 워크스테이션에 너무 많은 기계적 문제가 자주 발생했고 JEOL 엔지니어는 때때로 새로운 재료로 시스템과 부품을 재설계하고 도쿄의 아키시마에서 가져와 이전 재료로 교체해야 했습니다. 이러한 문제를 해결하기 위해 센서와 액추에이터를 조정합니다. 설치 후 약 반년 동안 거의 격주였습니다. 시편 스테이지는 더 높은 안정성을 위해 크게 재설계되었으며, 평행 조명 및 코마 없는 광학 정렬을 달성하기 위해 디스플레이에 원클릭 버튼을 도입하는 등 TEM 시스템 제어 소프트웨어도 개선되었습니다. cryoEM 방법은 개발 기간 동안 축적된 많은 지식을 유지하며 cryoTEM 시스템은 모든 필수 노하우와 사양을 구현하고 실현해야만 제대로 작동할 수 있습니다. JEOL 엔지니어들은 이 cryoTEM 시스템이 우리가 원하는 대로 작동하도록 정말 열심히 일했습니다. 이 프로토타입 CRYO ARM™의 모든 기능이 마침내 안정적으로 작동하기 시작한 것은 XNUMX년 XNUMX월이었고 그 이후로 심각한 문제는 없었습니다.
CRYO ARM™으로 수집한 이미지 데이터로 구조 분석의 도달 가능한 분해능을 확인하기 위해 β-갈락토시다아제를 테스트 샘플로 사용했습니다. 우리는 또한 추가 개선을 위해 하드웨어 및 소프트웨어의 작동 안정성에 대한 평가를 계속했으며 특히 모든 cryoEM 사용자가 편안하게 사용할 수 있도록 JEOL이 수년 동안 개발해 온 자동 데이터 수집 소프트웨어 프로그램인 JADAS에 중점을 두었습니다. 효율적인 데이터 수집. JADAS는 여러 업데이트를 거쳐 실질적으로 사용할 수 있게 되었으며, 2017년 여름에 우리는 2,500일 동안 β-갈락토시다아제의 cryoEM 그리드에서 3개의 이미지를 수집할 수 있었습니다. 그 중에서 약 350,000개의 단일 입자 이미지를 선택했고,
