JEM-1400Flash에 의한 생체 표본 관찰 ― 시료 준비에서 관찰까지의 흐름 ―
EM2021-01
개요
전자 현미경을 사용하면 광학 현미경으로는 불가능한 세포의 미세 구조를 관찰할 수 있습니다. 미토콘드리아, 엽록체 등 세포소기관의 상세한 구조를 이해하기 위해서는 전자현미경이 강력한 도구이다. 그러나 TEM은 진공 상태에서 관찰하기 때문에 살아있는 상태의 표본을 관찰할 수 없다. 또한 전자빔이 투과되기 위해서는 시료를 얇게 썰어야 합니다.
이를 위해 시편 준비는 인공물 없이 타겟의 구조를 파악하기 위한 매우 중요한 단계입니다. 이 애플리케이션 노트는 JEM-1400Flash로 얻은 데이터를 도입하기 위해 식물 조직의 예를 사용하여 생물학적 표본에 대한 샘플 준비 흐름을 설명합니다.
검체 준비의 흐름
생물학적 시료를 준비하는 방법에는 여러 가지가 있습니다. 예를 들어 화학적 고정법을 이용한 검체고정법과 울트라마이크로톰을 이용한 초박절편법을 소개한다. 시편 준비 프로세스는 다음 순서를 따릅니다. 1. 시편 절단, 2. 고정, 3. 탈수, 4. 대체, 5. 포함, 6. 중합, 7. 트리밍, 8. 초박 절편, 9. 염색. 각 프로세스는 아래에 설명되어 있습니다.
1. 표본 절단
표본은 면도날을 사용하여 작은 조각으로 절단되어 추가 처리에 사용되는 화학 물질이 쉽게 침투할 수 있습니다.
2. 고정
소수의 인공물만으로 생체시료의 구조적 변화를 멈추는 과정. 화학적 고정의 경우 고정은 접두사 및 사후 고정의 두 번 수행됩니다. Prefixation은 단백질을 고정하는 데 사용되며 Postfixation은 지질을 고정하는 데 사용됩니다.
참고: 사산화오스뮴은 휘발성 및 반응성이 높으며 사용자의 호흡기, 피부 및 점막을 손상시킬 수 있습니다. 따라서 흄 푸드에서 공정을 수행해야 합니다.
시약
- 프리픽스 용액: 2.5M HEPES*¹(하프 카르노브스키) 중 2% 글루타르알데히드 및 0.1% 파라포름알데히드
- 후고정 용액: 1% 오스뮴 테트록사이드 용액(OsO4 0.1M HEPES에서)
- 세척액: 0.1M HEPES 또는 증류수
- 샘플 병
*1 HEPES: 버퍼 용액 2-[4-(2-하이드록시에틸)-1-피페라지닐]에탄설폰산의 약어
3. 탈수
에탄올이나 아세톤을 사용하여 세포의 수분 함량을 탈수하십시오. 수분이 남아 있으면 남은 수분 함량이 후속 레진 포매 중에 레진의 중합을 방지합니다. 아래 흐름에 따라 시료를 각 농도의 에탄올에 담그어 수분 함량을 에탄올로 대체하십시오.

4. 교체
에탄올로 탈수할 때 중간제로 프로필렌옥사이드(PO) 등으로 치환하여 에폭시 수지와 블렌딩한다.
시약
- PO
- 에폭시 수지
※TAAB의 EPON 812*2 사용되었습니다.
- PO 전용 2x5분
- PO:수지=2:1 2시간
- PO:수지=1:1 2시간
- PO:수지=1:2 2시간
- 레진만 18~24시간
- 수지 조정 -
- EPON 812 측정*2, DDSA*3, MNA*4 표에 나온 비율대로 넣고 비커에 담는다.
- 교반기를 이용하여 잘 저어주세요
- DMP-30 추가*5 그리고 저어
- 수지 탈기 및 기포 제거
표: 에폭시 수지 컴파운딩
| (%) | 부드러운 | 매질 | 하드 |
|---|---|---|---|
| 에폰812 | 48 | 48 | 48 |
| DDSA | 30 | 19 | 12 |
| MNA | 20 | 33 | 40 |
| DMP-30 | 2 | 2 | 2 |
참조:TAAB 데이터 시트 12a
*2 EPON 812: 수지, *3 DDSA・*4 MNA: 경화제, *5 DMP-30:촉진제
5. 임베딩
초박 절편을 준비하기 위해서는 시편을 수지와 같은 단단한 매립제에 매립할 필요가 있다.
액체 레진은 나중에 중합 과정에서 경화됩니다.
도구
- 에폭시 수지
- 실리콘 임베딩 플레이트(그림 1)
- 수지를 붓는다
- 실리콘 임베딩 플레이트 끝에 시편을 놓습니다.
- 섞이도록 잠시 두세요

그림 1 실리콘 임베딩 플레이트
6. 중합
레진을 가열하여 경화시켜 레진을 얇게 슬라이스합니다. 실리콘 임베딩 플레이트를 오븐에 넣고 60°C에서 XNUMX일 동안 유지합니다. 중합 중 온도를 안정화하면 수지의 중합 실패를 방지할 수 있습니다.
도구
- 수지 중합용 오븐
7. 트리밍
관찰할 영역이 시편 그리드에 배치할 크기를 갖도록 광학 현미경으로 시편을 다듬고 관찰할 표면을 형성.
도구
- 면도날
- 광학현미경
8. 초박절편
유리 칼을 사용하여 조직의 표면을 노출하기 위해 수지를 제거합니다. 그런 다음 다이아몬드 나이프와 울트라마이크로톰을 사용하여 전자빔을 투과할 수 있을 만큼 얇게 슬라이스하고 그리드에 놓습니다.
도구
- 울트라마이크로톰
- 그리드
- 다이아몬드 나이프
- 유리 칼
- 속눈썹 프로브(그림. 2)

그림 2 속눈썹 탐침
9. 염색
이 작업은 많은 빛 요소를 포함하는 생물학적 표본의 대비를 향상시키는 데 사용됩니다. 무거운 원소를 표본에 결합하여 산란 대비를 향상시킵니다. 극박 절편을 그리드 상에서 염색할 때 염색제로 우라닐 아세테이트와 시트르산 납을 사용하여 이중 염색을 수행합니다. 우라닐 아세테이트는 핵형질과 리보솜을 염색하는 반면 시트르산 납은 세포막, 글리코겐 과립 및 리보솜을 염색합니다.
시약
- 우라닐 아세테이트*6
- 구연산 납
*6 우라닐 아세테이트는 허가된 시설에서만 사용할 수 있는 국제 규제 물질인 화합물입니다.
우라닐 아세테이트에 대한 대체 솔루션에는 이테르븀 아세테이트가 포함됩니다.
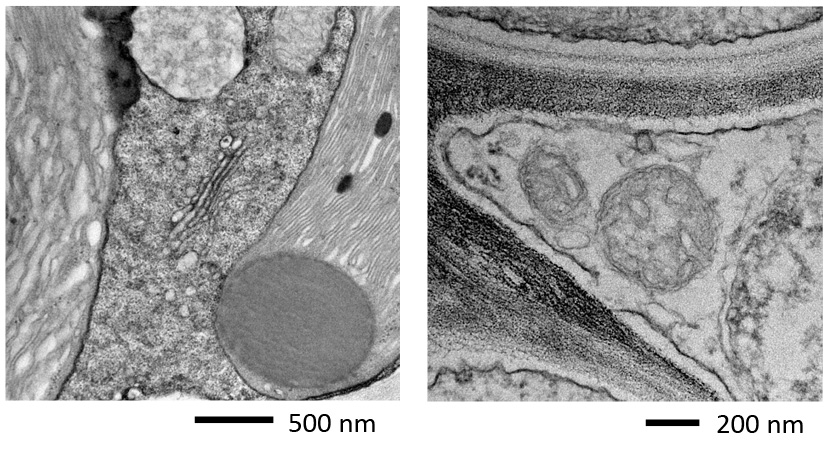
결과
Fig. 3은 TEM(JEM-1400Flash)을 이용하여 위의 흐름에 따라 제작된 초박단면 시편을 관찰한 결과이다.
- 추가 정보는 PDF 파일을 참조하십시오.
클릭하면 다른 창이 열립니다. 
PDF 1.2MB